Anvisa hace recomendaciones para el uso de la vacuna de Pfizer en niños

Tras autorizar el uso de la vacuna Pfizer en niños de entre 5 y 11 años , la Agencia Nacional de Vigilancia Sanitaria (Anvisa) presentó hoy (16) algunas recomendaciones y condiciones que deben ser observadas por las autoridades sanitarias para la inmunización de este público. Según el organismo, se debe redoblar la atención ya que tanto la dosis como la formulación de la vacuna a aplicar serán diferentes a las aplicadas a jóvenes y adultos.

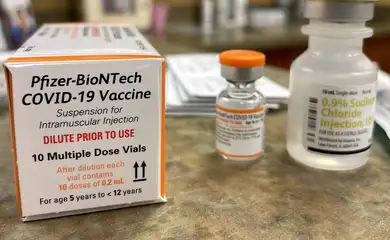
Al igual que en los otros grupos, la vacunación de los niños debe priorizar los grupos considerados de riesgo. Un punto muy importante, destacado por la directora de Anvisa y relatora del proceso de liberación de medicamentos, Meiruze Sousa Freitas, es que los padres o tutores estén pendientes del frasco de la vacuna, que será de color naranja. Para los adultos, la botella es de color violeta.
La administración de la vacuna en niños será de dos dosis de 10 microgramos con tres semanas de diferencia. “El volumen a aplicar es de 0,2 ml en una jeringa de 1 ml”, explicó el director.
Recomendaciones
Meiruze recordó que le corresponderá al Ministerio de Salud decidir sobre "conveniencia y oportunidad" de incluir la vacuna en el Programa Nacional de Inmunizaciones, pero le corresponde a Anvisa presentar las recomendaciones y condiciones que se deben seguir para la vacunación de niños en este grupo de edad.
“La vacunación de los niños en este grupo de edad debe comenzar luego de la capacitación completa de los equipos de salud que la aplicarán, ya que la gran mayoría de los eventos adversos posteriores a la vacunación se deben a la administración del producto equivocado en los grupos de edad equivocados, de dosis inadecuadas y preparación errónea del producto ”, dijo el director.
Otra recomendación de Anvisa es que la vacunación de los niños se realice en un “ambiente específico y segregado de la vacunación de adultos”. El entorno debe ser "acogedor y seguro para la población pediátrica". También se recomienda que los niños permanezcan en el lugar donde se realiza la vacunación durante al menos 20 minutos después de la aplicación, para ser observados durante este período.
La sala donde se administrará la vacuna debe ser exclusiva para la aplicación de esa vacuna. Y no debe utilizarse para la aplicación de otras vacunas, incluso pediátricas. Si no existe tal posibilidad en la infraestructura, para esta aplicación, se deben tomar todas las precauciones con miras a una administración segura.
En el caso de comunidades aisladas, como pueblos indígenas, Anvisa recomienda que, siempre que sea posible, la vacuna se realice en días separados, no coincidiendo con los días de aplicación en adultos.
Intervalo de 15 días
Según el director de Anvisa, la vacuna no debe administrarse concomitantemente con otras vacunas del calendario infantil. “Como precaución, se recomienda una pausa de 15 días”, dijo el director.
También debe evitarse la modalidad de vacunación impulsada por u.
Otra recomendación es que los trabajadores de la salud deben informar a los padres o tutores que acompañan a los niños y adolescentes sobre los síntomas y reacciones esperadas después de la vacunación, como dolor, hinchazón o enrojecimiento local, fiebre, fatiga, dolor de cabeza o adenopatías (ganglios) en la axila del brazo que recibió la vacuna.
"Los padres o tutores deben buscar un médico si el niño presenta dolor repentino en el pecho, dificultad para respirar o palpitaciones después de aplicar la vacuna", dijo el director. Los niños que cumplen 12 años en el intervalo entre la primera y la segunda dosis deben mantener la dosis pediátrica.
Secretarios de salud
El Consejo Nacional de Secretarios de Salud (Conass) emitió una nota en la que expresó su apoyo a la aprobación del agente inmunizante para esta audiencia. En él, el presidente de la organización, Carlos Lula, destaca que el inmunizante ya ha sido aprobado para el grupo de edad por la Agencia Europea de Medicamentos (EMA), la Administración Estadounidense de Alimentos y Medicamentos (FDA) y el gobierno israelí.
“Dado que para iniciar la vacunación en este grupo de edad será necesario formular específicamente esta vacuna con un tercio de la fórmula estándar [10 microgramos por dosis], Conass está a la espera de la posición del Ministerio de Salud respecto a su adquisición, que es su competencia. También esperamos el proceso de evaluación de la vacuna CoronaVac, del Instituto Butantan, para la vacunación de niños y adolescentes de 5 a 17 años, ya ampliamente utilizada en otros países, con disponibilidad inmediata en Brasil ”, dijo Carlos Lula.
Contactado por Agência Brasil , el Ministerio de Salud informó que aún no hay pronóstico sobre cuándo comenzará a aplicar la vacuna Pfizer en niños de entre 5 y 11 años.
amenazas
El director general de Anvisa, Antônio Barra Torres, aprovechó el anuncio para denunciar que todos los directivos de Anvisa recibieron amenazas -algunas de muerte- de personas contra la vacunación en niños.
Según Torres, "la intensificación de la violencia antivacunas va en aumento", pero el trabajo que está desarrollando el organismo no se verá perjudicado.
Informó que "no le corresponde a Anvisa, sino a las autoridades sanitarias, la aplicación del inmunizante".
Texto traducido mediante inteligencia artificial.